تبسيط كيمياء الثانوية العامة بالصوت والصورة , شرح السحابة الالكترونية والأوربيتال كيمياء الثانوية العامة بتبسيط شديد جدا لمستر سمير جابر جلال
للمزيد | عن السحابة الالكترونية والأوربيتال
تعريف السحابة الإلكترونية في الذرة
السحابة الإلكترونية هي منطقة الشحنة السالبة المحيطة بنواة الذرة المرتبطة بالمدار الذري. يتم تعريفه رياضيًا ، حيث يصف منطقة ذات احتمالية عالية لاحتواء الإلكترونات.
ظهر استخدام عبارة “السحابة الإلكترونية” لأول مرة حوالي عام 1925 ، عندما كان إروين شرودنجر وفيرنر هايزنبرغ يبحثان عن طريقة لوصف عدم اليقين في موضع الإلكترونات في الذرة.
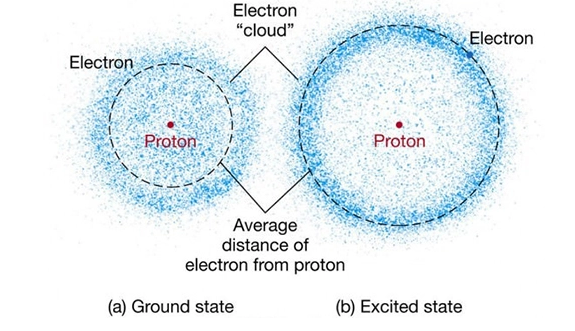
يختلف نموذج السحابة الإلكترونية عن نموذج بور الأكثر بساطة ، حيث تدور الإلكترونات حول النواة بنفس الطريقة التي تدور بها الكواكب حول الشمس .
في نموذج السحابة ، هناك مناطق يمكن أن يوجد فيها إلكترون على الأرجح ، ولكن من الممكن نظريًا أن يوجد في أي مكان ، بما في ذلك داخل النواة.
يستخدم الكيميائيون نموذج السحابة الإلكترونية لرسم خريطة المدارات الذرية للإلكترونات ، هذه الخرائط الاحتمالية ليست كلها كروية . تساعد أشكالهم في التنبؤ بالاتجاهات التي تظهر في الجدول الدوري.
ما هو الاوربيتال
تفسير ما هو الاوربيتال ، عادة ما يتم تحديد المدارات الذرية من خلال مجموعة من الأرقام والحروف التي تمثل خصائص محددة للإلكترونات المرتبطة بالمدارات على سبيل المثال: 1s ، 2p ، 3d ، 4f. تشير الأرقام ، التي تسمى أرقام الكم الرئيسية ، إلى مستويات الطاقة وكذلك المسافة النسبية من النواة .
يحتل إلكترون 1 ثانية مستوى الطاقة الأقرب للنواة . يقضي إلكترون 2 ثانية ، وهو أقل ارتباطًا بقوة ، معظم وقته بعيدًا عن النواة. تشير الأحرف ، s ، p ، d ، f إلى شكل المدار. يكون الشكل هو نتيجة لحجم الزخم الزاوي للإلكترون ، الناتج عن حركته الزاوية.
المدار s ومركزه في النواة . وبالتالي فإن إلكترون 1s يكون محصورًا بالكامل تقريبًا في منطقة كروية قريبة من النواة يقتصر إلكترون 2s على كرة أكبر إلى حد ما.
المدار p له الشكل التقريبي لزوج من الفصوص على جانبي النواة ، أو شكل دمبل إلى حد ما. الإلكترون في المدار p لديه احتمال متساوٍ لكونه في النصف أشكال المدارات الأخرى أكثر تعقيدًا. تم استخدام الأحرف s و p و d و f في الأصل لتصنيف الأطياف بشكل وصفي إلى سلسلة تسمى حادة ، أساسية ، منتشرة ، وأساسية ، قبل معرفة العلاقة بين الأطياف وتكوين الإلكترون الذري.
نموذج بور
نموذج بور ، وصف بنية الذرات ، وخاصة هيكل الهيدروجين ، اقترحه الفيزيائي الدنماركي نيلز بور (1913). كان نموذج بور للذرة ، وهو خروج جذري عن الأوصاف الكلاسيكية السابقة ، أول نموذج يتضمن نظرية الكم وكان سلفًا لنماذج ميكانيكا الكم بالكامل.
يصف نموذج بور وجميع تلاه خصائص الإلكترونات الذرية من حيث مجموعة من القيم المسموح بها او الممكنة . تمتص الذرات أو تنبعث منها الإشعاع فقط عندما تقفز الإلكترونات فجأة بين الحالات المسموح بها أو الثابتة. تم الحصول على دليل تجريبي مباشر لوجود مثل هذه الحالات المنفصلة (1914) من قبل الفيزيائيين المولودين في ألمانيا جيمس فرانك وجوستاف هيرتز.
قبل عام 1913 مباشرة ، كان يُعتقد أن الذرة تتكون من نواة ثقيلة موجبة الشحنة صغيرة تسمى النواة ، محاطة بإلكترونات ضوئية سالبة كوكبية تدور في مدارات دائرية من أنصاف أقطار عشوائية.
عدل بور وجهة النظر هذه لحركة إلكترونات الكواكب لجعل النموذج يتماشى مع الأنماط العادية او السلاسل الطيفية للضوء المنبعث من ذرات الهيدروجين الحقيقية.
من خلال قصر الإلكترونات التي تدور في المدار على سلسلة من المدارات الدائرية التي لها أنصاف أقطار منفصلة ، يمكن أن يفسر بور سلسلة الأطوال الموجية المنفصلة في طيف انبعاث الهيدروجين. اقترح أن الضوء يشع من ذرات الهيدروجين فقط عندما ينتقل الإلكترون من مدار خارجي إلى مدار أقرب إلى النواة. الطاقة التي يفقدها الإلكترون في الانتقال المفاجئ هي بالضبط نفس طاقة كمية الضوء المنبعث.