تلخيص الدرس الأول (التفاعلات الكيميائية) علوم 3 اعدادي فى ورقتين

التفاعلات الكيميائية
تكتسب التفاعلات الكيميائية أهمية كبرى في حياتنا , فالبنزين يحترق في محرك السيارة لتوليد طاقة تحركها , وغذاء النبات ينتج من عملية البناء الضوئي بتفاعل ثاني أكسيد الكربون والماء .
والأنواع المختلفة من الأدوية والألياف الصناعية والأسمدة ما هي إلا بعض الأمثلة على نواتج بعض التفاعلات الكيميائية .
التفاعل الكيميائي هو كسر الروابط الموجودة في جزيئات المواد المتفاعلة وتكوين روابط جديدة في جزيئات المواد الناتجة من التفاعل .
ولكن هل التفاعلات الكيميائية متماثلة ؟
تختلف التفاعلات الكيميائية وفقا للعمليات التي تتضمنها , ويمكن أن تقسم التفاعلات الكيميائية إلى عدة أنواع .
أولا : تفاعلات الانحلال الحراري
في هذا النوع من التفاعلات الكيميائية يتفكك المركب بالحرارة إلى مكوناته البسيطة , فقد يتفكك كليا إلى عناصره الأولية أو مركبات أبسط منه , ويمكن تمثيل تفاعلات الانحلال باستخدام دبابيس الورق كما بالشكل (2)
نشاط : اكتشف بعض المواد تنحل بالحرارة .
الأدوات : أكسيد زئبق أحمر – هيدروكسيد نحاس – كربونات نحاس – كبريتات النحاس – نترات صوديوم – أنابيب اختبار – لهب – عود ثقاب .
الخطوات :
1- ضع قليلا من أكسيد الزئبق في أنبوبة اختبار .
2- سخن أكسيد الزئبق باستخدام اللهب .
3- قرب عود ثقاب مشتعل من فوهة أنبوبة الاختبار .
ماذا تلاحظ ؟
4- كرر الخطوات السابقة مع باقي المركبات بالنشاط .
5- سجل ملاحظاتك على كل مادة .
• تنحل بعض أكاسيد الفلزات بالحرارة إلى الفلز والأكسجين , فينحل أكسيد الزئبق الأحمر بالحرارة إلى الزئبق (فضي اللون) الذي يترسب في قاع الأنبوبة وغاز الأكسجين الذي يتصاعد عند فوهة الأنبوبة , والذي يسبب زيادة توهج عود الثقاب المشتعل .
2HgO 2Hg + O2
• كما تنحل بعض هيدروكسيدات الفلز عند تسخينها إلى أكسيد الفلز والماء , فينحل هيدروكسيد النحاس (أزرق اللون) بالحرارة إلى أكسيد النحاس (أسود اللون) وبخار الماء .
Cu(OH)2 CuO + H2O
• وتنحل معظم كربونات الفلز عند تسخينها إلى أكسيد الفلز وثاني أكسيد الكربون , فتنحل كربونات النحاس (أخضر اللون) بالحرارة إلى أكسيد النحاس (أسود اللون) وغاز ثاني أكسيد الكربون .
CuCO3 CuO + CO2
• وتنحل معظم كبريتات الفلز عند تسخينها إلى أكسيد الفلز غاز ثالث أكسيد الكبريت , فتنحل كبريتات النحاس (أخضر اللون) بالحرارة إلى أكسيد النحاس (أسود اللون) وغاز ثالث أكسيد الكبريت .
CuSO4 CuO + SO3
• وتنحل جميع نترات الفلزات عند تسخينها ويتصاعد غاز الأكسجين , فتنحل نترات الصوديوم (أبيض اللون) بالحرارة إلى نيتريت الصوديوم (أبيض مصفر) وغاز الأكسجين .
2NaNO3 2NaNO2 +O2
ثانيا : تفاعلات الإحلال
تحدث تفاعلات الإحلال عندما يكون هناك عنصر نشط "أكثر فاعلية" يحل محل عنصر آخر ذي نشاط "أقل فاعلية" في مركب آخر .
وتحدد هذه التفاعلات عادة بمعرفة العناصر الأكثر نشاطا من خلال متسلسلة النشاط الكيميائي (متسلسلة النشاط الكيميائي هي ترتيب العناصر الفلزية ترتيبا تنازليا حسب درجة نشاطها الكيميائي , ويحل العنصر الأكثر نشاطا محل العنصر الأقل نشاطا) .
وتحل العناصر التي تسبق الهيدروجين في السلسلة محل الهيدروجين في الأحماض, أما التي تلي الهيدروجين في السلسلة فلا تحل محله في الأحماض إلا بشروط كيميائية خاصة .
تذكر أولا
الليثيوم Li
البوتاسيوم K
الصوديوم Na
الباريوم Ba
الكالسيوم Ca
الماغنسيوم Mg
الألومنيوم Al
الخارصين Zn
الحديد Fe
القصدير Sn
الرصاص Pb
الهيدروجين H
النحاس Cu
الزئبق Hg
الفضة Ag
الذهب Au
تنقسم تفاعلات الإحلال إلى نوعين :
(أ) تفاعلات الإحلال البسيط :
هي تفاعلات يتم فيها إحلال عناصر محل عنصر آخر , بشرط أن يكون العنصر الذي سيحل محل غيره أكثر نشاطا منه .
ويمكن تمثيل تفاعلات الإحلال البسيط باستخدام دبابيس الورق كما بالشكل (6)
1) إحلال فلز محل هيدروجين الماء أو الحمض :
تحل الفلزات محل هيدروجين الماء , وينتج هيدروكسيد الفلز ويتصاعد غاز الهيدروجين .
نشاط : اكتشف تفاعل الماء مع الصوديوم .
الأدوات : قطعة صوديوم صغيرة – كأس بها ماء .
الخطوات : ضع قطعة الصوديوم في كأس الماء .
ماذا تلاحظ ؟
ماذا تستنتج ؟
(خطر) احتياطات الأمان :
• كن حذرا عند إجراء هذا التفاعل , لأنه يؤدي إلى انفجار واشتعال , كما يجب وضع قطعة صغيرة جدا من الصوديوم .
معادلة التفاعل هي :
2Na + 2H2O 2NaOH + H2 + حرارة
تتفاعل بعض الفلزات مع الماء , حيث تحل الفلزات محل هيدروجين الماء وينتج ملح ويتصاعد غاز الهيدروجين .
نشاط : اكتشف إحلال الفلزات محل هيدروجين الحمض .
الأدوات : حمض كبريتيك مخفف – 3 كؤوس – خارصين – خراطة ألومنيوم – خراطة نحاس .
الخطوات :
1- ضع في الكأس الأولى قليلا من الخارصين , وفي الثانية قليلا من خراطة ألومنيوم , وفي الثالثة خراطة النحاس .
2- ضع في كل كأس قليلا من حمض الهيدروكلوريك المخفف .
ماذا تلاحظ ؟
• ماذا تلاحظ في كأس الخارصين ؟ .........
• هل حدث تفاعل مع خراطة النحاس ؟ ...............................
لا يتفاعل النحاس بإضافة حمض الهيدروكلوريك المخفف , بينما يتفاعل الخارصين في الحال مكونا ملحا وغاز الهيدروجين .
Zn + 2HCl ZnCl2 + H2
وبعد فتر قليلة يكون الخارصين قد تفاعل تماما ويكون الألومنيوم قد بدأ في التفاعل مكونا ملحا وغاز الهيدروجين الذي يكون أعنف من تفاعل الخارصين , أما النحاس فلا يتفاعل .
2Al + 6HCl 2AlCl3 + 3H2
2) إحلال فلز محل آخر في أملاحه :
بعض الفلزات يمكن أن تحل محل فلزات أخرى في محاليل أملاح الفلزات التي تليها في متسلسلة النشاط الكيميائي .
نشاط : إحلال فلز محل آخر في أحد أملاحه .
الأدوات : كأس – كبريتات نحاس زرقاء – قطع ماغنسيوم .
الخطوات : ضع قطع الماغنسيوم في كأس بها كبريتات نحاس زرقاء .
لاحظ التغيرات التي تحدث .
عنصر الماغنسيوم أكثر نشاطا من عنصر النحاس , لذلك يحل محله في محلول كبريتات النحاس , حيث يترسب النحاس (بني محمر) في الكأس ويتحول المحلول إلى كبريتات الماغنسيوم .
Mg = CuSO4 MgSO4 + Cu
(ب) تفاعلات الإحلال المزدوج :
هي تفاعلات تتم فيها عملية تبادل مزدوج بين شقي (أيونات) مركبين لينتجا مركبين جديدين , ويتم في هذا التفاعل الاستبدال بين العناصر في المواد المتفاعلة , بحيث يأخذ كل عنصر مكان العنصر الآخر ليكونا مركبين مختلفين في المواد المتفاعلة .
وتنقسم أنواع تفاعلات الإحلال المزدوج إلى :
(1) تفاعل حمض مع قلوي (التعادل)
التعادل هو تفاعل حمض وقلوي لتكوين ملح وماء .
حمض + قلوي ملح + ماء
مثل تفاعل حمض الهيدروكلوريك مع هيدروكسيد الصوديوم , وينتج ملح كلوريد الصوديوم وماء , وعند تسخين المحلول يتبخر الماء ويتبقى كلوريد الصوديوم .
NaOH + HCl NaCl + H2O
(2) تفاعل الحمض مع الملح
تتفاعل الأحماض مع الأملاح ويتوقف ناتج التفاعل على نوع كل من الحمض والملح .
نشاط : اكتشف تفاعل حمض الهيدروكلوريك وكربونات الصوديوم .
المواد والأدوات : حمض هيدروكلوريك – مسحوق كربونات صوديوم – دجاجة بلاستيك – بالون .
الخطوات :
1- ضع كمية من حمض الهيدروكلوريك في الزجاجة .
2- ضع كمية من كربونات الصوديوم في البالون .
3- أدخل فوهة البالون في فوهة الزجاجة .
4- اقلب البالون برفق , بحيث تسقط كمية كربونات الصوديوم في الزجاجة .
ماذا تلاحظ داخل الزجاجة ؟
ماذا تلاحظ على شكل البالون ؟
5- بحرص شديد أغلق فوهة البالون , ثم انزع البالون من الزجاجة .
6- مرر الغاز المتجمع في البالون في ماء جير رائق .
ماذا تلاحظ ؟
يتفاعل حمض الهيدروكلوريك مع كربونات الصوديوم ويتكون كلوريد الصوديوم وماء وغاز ثاني أكسيد الكربون الذي يعكر ماء الجير الرائق .
Na2CO3 + 2HCl 2NaCl + H2O + CO2
(3) تفاعل محلول ملح مع محلول ملح آخر
تفاعلات الإحلال المزدوج بين محاليل الأملاح تكون مصحوبة بتكوين راسب , عند إضافة محلول نترات الفضة إلى محلول كلوريد الصوديوم يتكون راسب أبيض من كلوريد الفضة .
NaCl + AgNO3 NaNO3 + AgCl
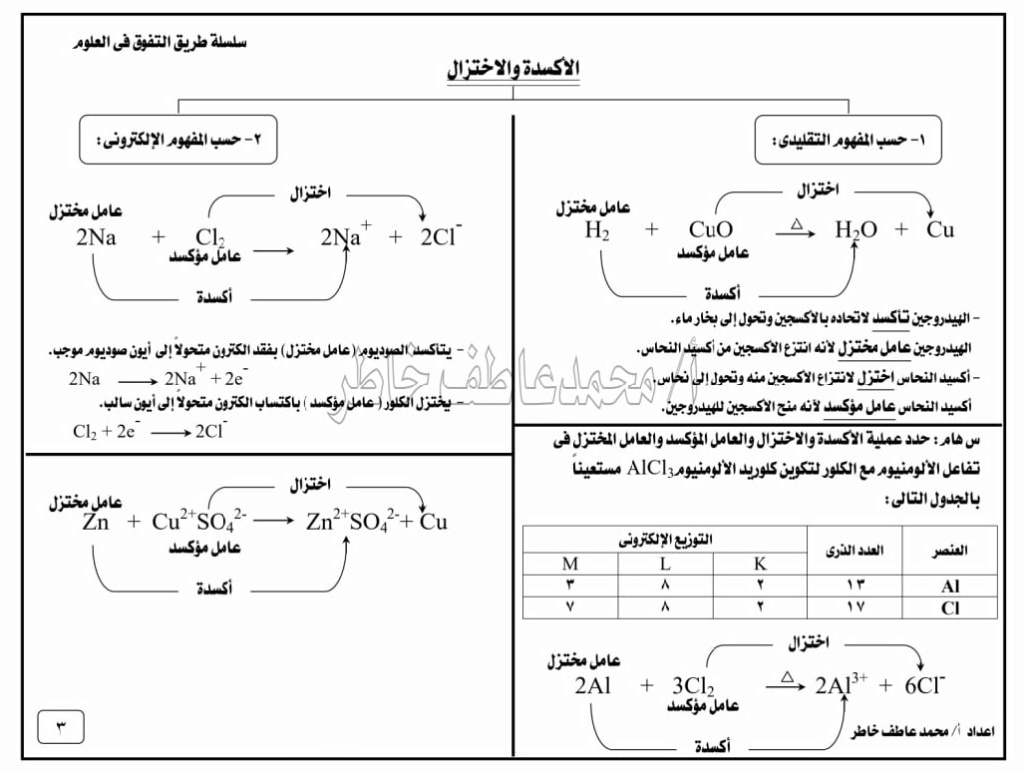
(جـ) الأكسدة والاختزال :
عند إمرار غاز الهيدروجين على أكسيد النحاس الساخن فإن الهيدروجين ينتزع الأكسجين من أكسيد النحاس ويتكون الماء , ويتحول , ويتحول أكسيد النحاس إلى النحاس .
H2 + CuO Cu + H2O
في هذا التفاعل يقال إن الهيدروجين قد تأكسد , لأنه اتحد مع الأكسجين , بينما أكسيد النحاس قد اختزل , لأنه نزع منه الأكسجين .
ونقول أيضا إن أكسيد النحاس عامل مؤكسد , لأنه أكسد الهيدروجين , بينما الهيدروجين عامل مختزل , لأنه اختزل أكسيد النحاس إلى نحاس .
الأكسدة هي عملية كيميائية ينتج عنها زيادة نسبة الأكسجين في المادة أو نقص نسبة الهيدروجين فيها الاختزال هو عملية كيميائية ينتج عنها نقص نسبة الأكسجين في المادة أو زيادة نسبة الهيدروجين فيه
العامل المؤكسد هو المادة التي تعطي الأكسجين أو تنتزع الهيدروجين أثناء التفاعل الكيميائي العامل المختزل هو المادة التي تنتزع الأكسجين أو تعطي الهيدروجين أثناء التفاعل الكيميائي
هناك تفاعلات كيميائية تتضمن عمليات تأكسد واختزال ولا تحتوي على أكسجين أو هيدروجين , فعند تفاعل الصوديوم مع الكلور تحدث عملية أكسدة واختزال ينتج عنها تكون كلوريد الصوديوم أو ما يعرف باسم ملح الطعام .
تعلمت أن تكافؤ الصوديوم أحادي لأنه يفقد إلكترونا واحدا , بينما تكافؤ الكلور أحادي لأنه يكتسب إلكترونا واحدا , ويكون التعبير عن التفاعل السابق بالمعادلة التالية :
2Na + Cl2 2NaCl
نلاحظ في هذا التفاعل أن ذرة الصوديوم تحولت إلى أيون الصوديوم , بينما تحولت ذرة الكلور إلى أيون الكلور .
ذرة الصوديوم فقدت إلكترونا واحدا وتحولت من ذرة متعادلة إلى أيون الصوديوم الموجب +1 وتسمى تلك العملية أكسدة .
2Na 2Na+ + 2e-
وحيث إن الإلكترونات لا يمكن أن تبقى حرة فإنها تنتقل إلى ذرات الكلور (تكتسب إلكترونات) وتتحول إلى أيونات الكلور السالبة –1 , وتسمى تلك العملية "اختزالا" .
Cl2 + 2e- 2Cl-
الأكسدة عملية كيميائية تفقد فيها ذرة العنصر3إلكترونا أو أكثر . الاختزال عملية كيميائية تكتسب فيها ذرة العنصر إلكترونا أو أكثر
العامل المؤكسد هو المادة التي تكتسب إلكترونا أو أكثر أثناء التفاعل العامل المختزل هو المادة التي تفقد إلكترونا أو أكثر أثناء التفاعل الكيميائي .
نلاحظ أن عمليتي الأكسدة والاختزال عمليتان متلازمتان تحدثنا معا .
تدريبات على الدرس الأول
(1) أكمل العبارات التالية :
1- عملية الأكسدة عملية كيميائية ........... فيها ذرة العنصر إلكترونا أو أكثر .
2- العامل .......... هو المادة التي تفقد إلكترونا أو أكثر أثناء التفاعل الكيميائي .
3- تفاعلات ......... يتفكك المركب بالحرارة إلى مكوناته البسيطة .
4- عملية ........... هي تفاعل حمض وقلوي لتكوين ملح وماء .
5- هو المادة التي تعطي الأكسجين أو تنتزع الهيدروجين ...............
(2) اكتب المصطلح العلمي الذي تدل عليه العبارات التالية :
1- كسر الروابط الموجودة في جزيئات المواد المتفاعلة وتكوين روابط جديدة .
2- عملية كيميائية تكتسب فيها ذرة العنصر إلكترونا أو أكثر .
3- هو المادة التي تفقد إلكترونا أو أكثر أثناء التفاعل الكيميائي .
4- عملية كيميائية ينتج عنها زيادة نسبة الأكسجين في المادة أو نقص نسب الهيدروجين فيها .
5- تفاعلات يتم فيها إحلال عنصر محل عنصر آخر .
(3) وضح بالمعادلات الرمزية المتزنة التفاعلات التالية :
1- تفاعل حمض الهيدروكلوريك مع هيدروكسيد الصوديوم .
2- إضافة محلول نترات الفضلة إلى محلول كلوريد الصوديوم .
3- أثر الحرارة على أكسيد الزئبق (الأحمر) .
4- تفاعل الخارصين مع حمض الهيدروكلوريك المخفف .
5- أثر الحرارة على نترات الصوديوم .
(4) حدد عملية الأكسدة والاختزال والعامل المؤكسد والعامل المختزل في تفاعل الألومنيوم مع الكلور لتكوين كلوريد الألومنيوم Al Cl3
الألومنيوم Al العدد الذري 13 التوزيع الإلكتروني
الكلور Cl العدد الذري 17 التوزيع الإلكتروني
المستوى
العنصر K L M
Al 2 8 3
Cl 2 8 7