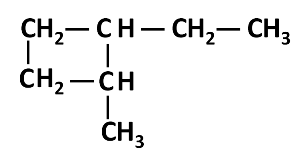
ترتبط العناصر في المركبات العضوية بروابط تساهمية
وكل عنصر يرتبط بعدد من الروابط مساوٍ لتكافئه . فالرابطـــة التــساهميــة
العادية اكثر الروابـط شيوعـاً في المركبات العضويـة وهي عبارة عن زوج
من الالكترونات يربط بين ذرتين تكون نتيجـة مساهمــة كل من الذرتين
بالكتـرون واحــد من مستــوى التكافؤ.
وكل عنصر يرتبط بعدد من الروابط مساوٍ لتكافئه . فالرابطـــة التــساهميــة
العادية اكثر الروابـط شيوعـاً في المركبات العضويـة وهي عبارة عن زوج
من الالكترونات يربط بين ذرتين تكون نتيجـة مساهمــة كل من الذرتين
بالكتـرون واحــد من مستــوى التكافؤ.










مس رباب2011-12-18, 9:50 pm